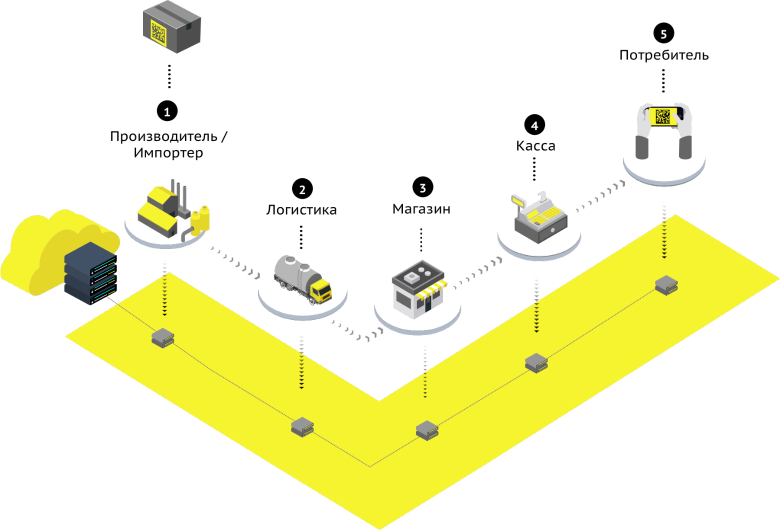
Маркировка табачных изделий и сигарет - пошаговая инструкция регистрации в системе Честный ЗНАК
Сертификат электронной подписи можно получить в одном из аккредитованных Минкомсвязью России удостоверяющих центров.
Если у вас уже есть электронная подпись, то вы можете использовать ее.
ВАЖНО: Подпись должна быть выпущена на руководителя организации или ИП
Если вы не получили инструкцию по настройке, воспользуйтесь нашей:
Перейдите на сайт https://markirovka.tobacco.crpt.ru/register
Обеспечьте наличие соответствующей операционной системы, программного обеспечения и плагинов.
Инструкция по установке ПО
Нажмите проверить.
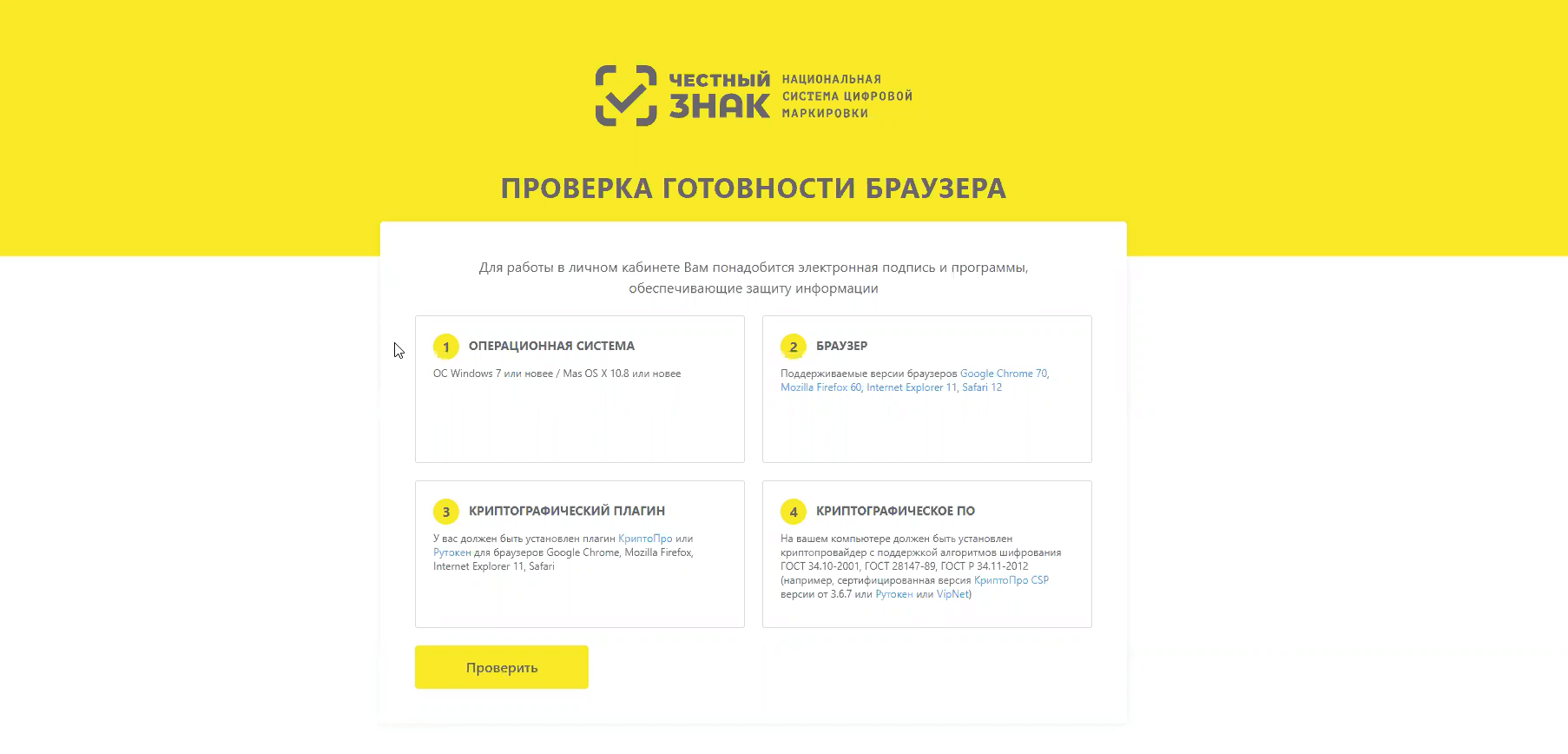
Если все компоненты установлены, нажмите продолжить.

Выберите сертификат электронной подписи и нажмите войти.

Заполните e-mail и телефон, нажмите отправить заявку.
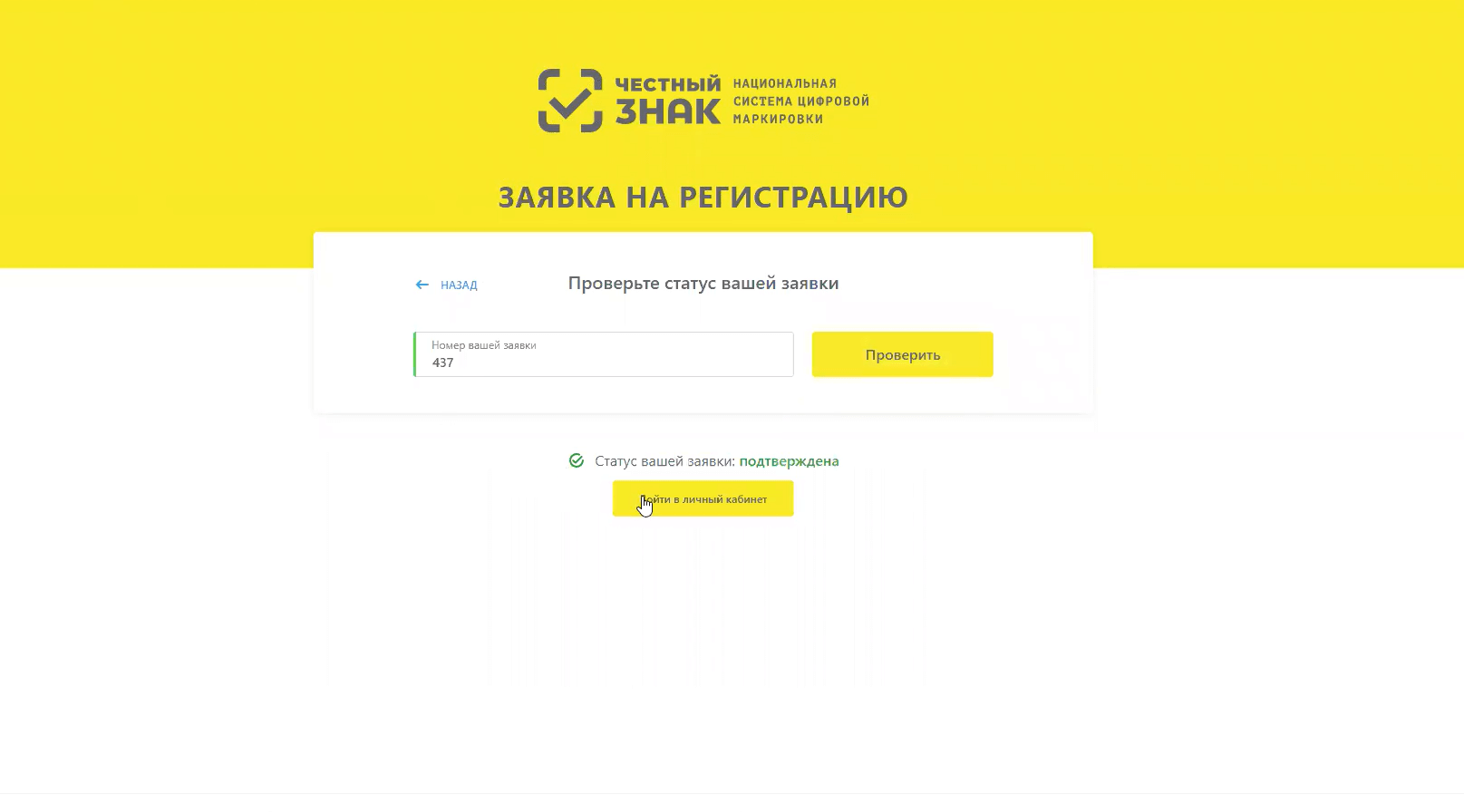
Проверить статус заявки вы можете в открывшемся окне.

В случае подтверждения заявки вы сможете войти в личный кабинет.
Выберите сертификат электронной подписи и нажмите войти.

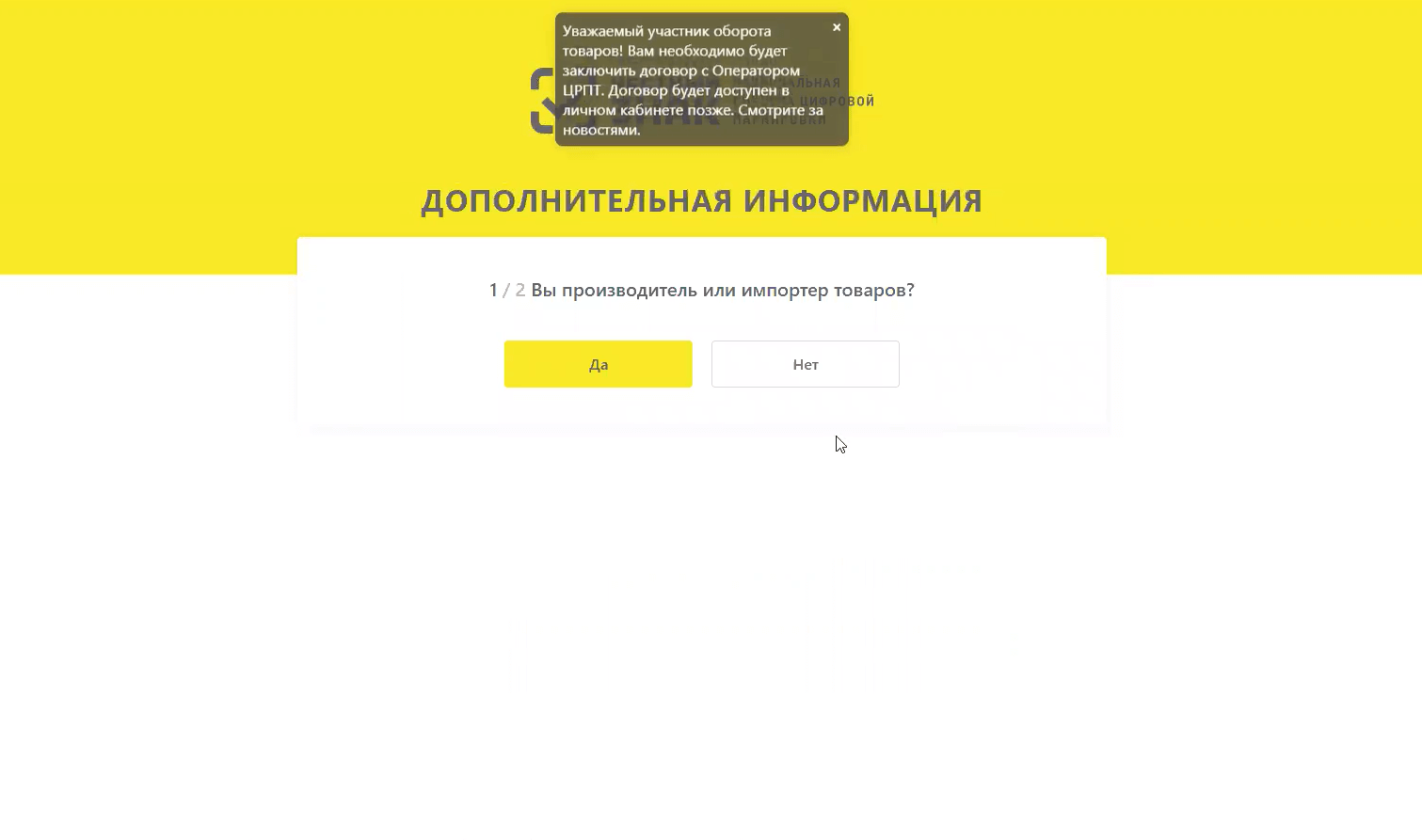
Укажите являетесь ли вы производителем или импортером товаров. Если вы осуществляете оптовую или розничную торговлю, нажмите нет.
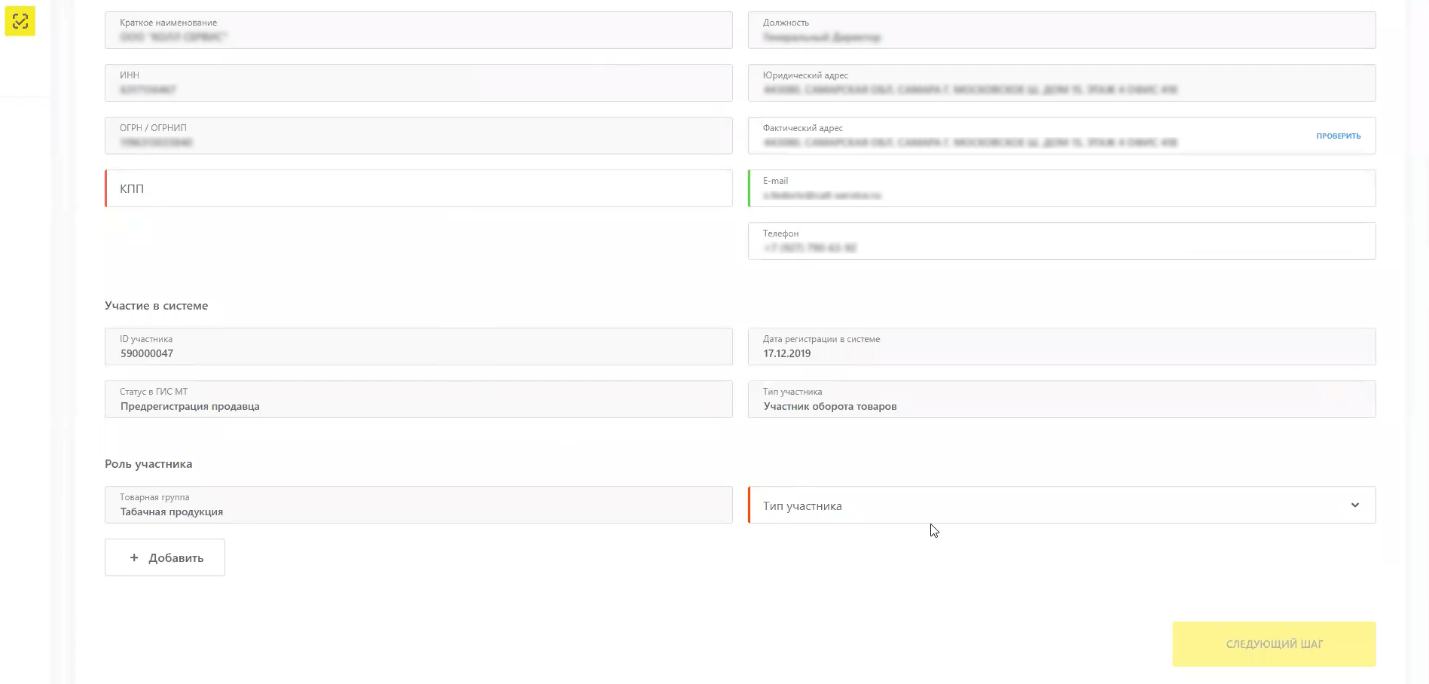
Заполните КПП и роль участника в открывшемся окне.
При необходимости добавьте пользователей.

Информация по подготовке магазина для работы с маркированными сигаретами по ссылке
Нажимая «Отправить заявку», вы даёте согласие на передачу указанных в Анкете данных техническим партнерам «Честный ЗНАК», на получение дополнительной информации и новых предложений от Честный ЗНАК и технических партнеров. Политика конфиденциальности.